ниобия оксиды
НИОБИЯ ОКСИДЫ
Наиб. известны монооксид NbO, диоксид NbO2, оксид Nb(V) (пентаоксид диниобия) Nb2O5 с узкими областями гомогенности. Кроме того, существует неск. метастабильных оксидов (их свойства мало изучены) NbOx (x ~ 1/6 — 1/2), которые образуются в виде пленок на начальных стадиях окисления Nb и при распаде пересыщ. твердых растворов кислорода в ниобии. Найдено также неск. оксидов состава NbO2,42 _ 2,50. При нагр. на воздухе или в среде O2 все низшие оксиды окисляются до Nb2O5.
О к с и д н и о б и я(V) Nb2O5 — бесцветные кристаллы; для него описано не менее 10 кристаллич. модификаций (см. табл.), причем стабильна при 0,1 МПа только р-форма (H-Nb2O5), в которую остальные превращ. при нагр. до 1000–1100 °C. При нагр. Nb2O5∙xH2O или аморфного Nb2O5 на воздухе до 600–800 °C получают a-Nb2O5 (T-Nb2O5), который необратимо превращ. в a'-форму (B-Nb2O5), а затем при 957 °C — в b-Nb2O5. B-модификация имеет наиб. плотн. (5,29 г/см3). Остальные модификации (вероятно, стабилизируются примесями) получают методом хим. транспортных реакций из хлоридов, бромидов или фторидов Nb(V). Структура b-Nb2O5 построена из блоков октаэдров, связанных общими вершинами, между собой блоки соединены ребрами; т. пл. 1510 °C; плотн. 4,55 г/см3; давление пара при 1720 К менее 2,4∙10−3 Па; C0p 132,1 Дж/(моль∙К); ΔH0обр −1897,9 кДж/моль; S0298 137,2 Дж/(моль∙К); полупроводник, ширина запрещенной зоны 1,65 эВ (300 К). Nb2O5 не раств. в воде и почти не раств. в кислотах, кроме фтористоводородной, с которой образует H2NbF7 или H2NbOF5. Водородом восстанавливается до низших оксидов, с NH3 при 530–830 °C образует NbN, с Cl2 при 1000–1060 °C и с CCl4 при 230 °C — оксихлориды и пентахлорид Nb. При нагр. Nb2O5 с др. оксидами получают многочисл. ниобаты, а также двойные оксиды со структурами, близкими к b-Nb2O5, которые считались ранее твердыми растворами (Ti2Nb10O29, FeNb49O124 и т. д.).
Получают Nb2O5 прокаливанием гидроксида Nb(V) при 600–1000 °C, гидролизом NbCl5, сжиганием Nb или его карбида в кислороде. Nb2O5-промежут. продукт при получении Nb, его сплавов, NbC, ниобатов и др. соед., компонент огнеупоров, керметов, керамики, стекол с высоким коэф. преломления, не пропускающих ИК излучение.
КРИСТАЛЛИЧЕСКИЕ МОДИФИКАЦИИ ОКСИДОВ НИОБИЯ
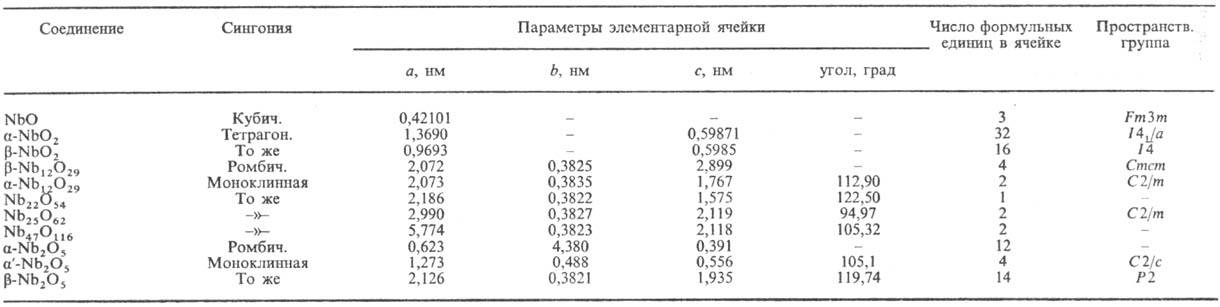
М о н о о к с и д NbO-серые кристаллы со структурой типа NaCl с упорядоченным расположением вакансий ниобия и кислорода; макс. область гомогенности NbO0,982–1,008; т. пл. 1945 °C; плотн. 7,26 г/см3; С0р 41,25 Дж/(моль∙К);ΔH0обр −405,85 кДж/моль; S0298 50,2 Дж/(моль∙К); обладает металлич. проводимостью, r10−5 Ом∙см (300 К); температура перехода в сверхпроводящее состояние 1,5 К; ок. 2330 °C интенсивно испаряется с диспропорционированием на Nb и O2, что используется при рафинировании Nb методом электроннолучевой плавки; получают восстановлением Nb2O5 водородом ок. 1030 °C или спеканием смеси Nb и Nb2O5 в вакууме при 1130–1330 °C.
Д и о к с и д NbO2-черные кристаллы. Низкотемпературная a-форма имеет искаженную структуру рутила (из-за образования связей Nb—Nb); т. пл. 1917 °C; плотн. 5,98 г/см3; давление пара 1,49 Па при 2122 К; C0p 57,49 Дж/(моль∙К); ΔH0обр −795,38 кДж/моль; S0298 54,52 Дж/(моль∙К); полупроводник, ширина запрещенной зоны 0,26 эВ (300 К); r 14 Ом∙см (300 К). При 797 °C a-форма переходит в модификацию с неискаженной структурой рутила и металлич. проводимостью, DH перехода 2,5 кДж/моль. Методом хим. транспортных реакций из NbCl5 или Nb3O7Cl получен b-NbO2 (отношение O:Nb = 1,990–1,988) с иным типом искажения структуры рутила; вероятно, метастабилен. В системах с диоксидами MO2(М = V, Ti, Ta, Mo) помимо твердых растворов найдены фазы с неискаженной с т р у к т у р о й р у т и л а Nb1-xMxO2. Получают NbO2 спеканием смеси Nb2O5 и Nb в вакууме при 1130 °C или как промежут. продукт при восстановлении Nb2O5 водородом.
В системе Nb-O с областью гомогенности NbO2,42–2,50 обнаружено неск. оксидов сложного состава, разлагающихся по перитектич. реакциям. Они имеют структуру, родственную b-Nb2O5, и ранее принимались за одну фазу переменного состава Nb2O5-х. В системе Nb-O найдены три эвтектики: раствор O2 в Nb-NbO, температура 1915 °C; NbO-NbO2, температура 1810 °C; NbO2-Nb2O5, температура 1510 °C.
Лит.: Rao C.N.R., Rao G.V. Subba, Transition metal oxides, Wash., 1974, p. 92–99 (National Standart reference date system, v. 49). См. также лит. при ст. ниобий.
Л. М. Ковба
