терефталоилхлорид
ТЕРЕФТАЛОИЛХЛОРИД (дихлорангидрид терефталевой кислоты) C6H4(COCl)2
мол. м. 203,03; бесцветные кристаллы с острым запахом; т. пл. 82–84 °C, т. кип. 266 °C, 141 °C/16 мм рт. ст.; давление пара (кПа): 0,27 (112 °C), 1,46 (136 °C), 2,53 (150 °C); уравнение температурной зависимости давления пара: lgp (кПа) = — 2937/Т+ 6,25 (400–523 К); 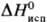 56,23 кДж/моль,
56,23 кДж/моль, 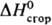 — 3387,2 кДж/моль,
— 3387,2 кДж/моль, 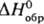 — 384,22 кДж/моль;
— 384,22 кДж/моль; 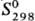 509,5 Дж/(моль∙К). Легко раств. в диэтиловом эфире, бензоле, ацетоне, бензине, CCl4.
509,5 Дж/(моль∙К). Легко раств. в диэтиловом эфире, бензоле, ацетоне, бензине, CCl4.
Т. гидролизуется водой, водными растворами кислот и оснований до терефталевой кислоты; реагирует со спиртами и аминами с образованием соответствующих сложных эфиров и амидов терефталевой кислоты. Хлорирование Т. осуществляют обычно при 165–170 °C в присутствии железной стружки и молярном соотношении Т. :Cl2 = 1:10; осн. продукт реакции-дихлорангидрид тетрахлортерефталевой кислоты (выход 65%). При этом в заметной степени протекает побочная реакция отщепления групп COCl, что приводит к образованию гексахлорбензола.
В промышленности Т. получают гидролизом гексахлор-и-ксилола C6H4(CCl3)2 при 110–120 °C (кат. — FeCl3); выход более 90%. Удобный способ получения Т. — взаимод. терефталевой кислоты с гексахлор-и-ксилолом в присутствии FeCl3 при 85–120 °C. В лаборатории Т. получают реакцией терефталевой кислоты с SOCl2.
Т. — промежут. продукт при синтезе полиамидов (волокна типа фенилона), полиарилатов, пластификаторов (напр., полидиаллилфталаты), лекарственных средств, красителей; сшивающий агент для полиуретанов и полисульфидов.
Т. горюч, невзрывоопасен; т. всп. 152 °C (открытый тигель), т. воспл. 1050 °C. Для пылевоздушной смеси Т. дисперсностью до 125 мкм ниж. КПВ 73 г/м3. Обладает местным раздражающим действием; ПДК 0,1 мг/м3 (рекомендуемая).
Лит.: Промышленные хлорорганические продукты. Справочник, под ред. Л. А. Ошина, М., 1978; Моцарев Г. В., Успенская И. Н., Хлорпроизводные алкилароматических углеводородов. Получение и переработка, М., 1983.
Ю. А. Трегер
